Біохімія трансгенної картоплі в умовах України
`МІНІСТЕРСТВО АГРАРНОЇ ПОЛІТИКИ УКРАЇНИ
СУМСЬКИЙ ДЕРЖАВНИЙ АГРАРНИЙ УНІВЕРСИТЕТ
АГРОНОМІЧНИЙ ФАКУЛЬТЕТ
Кафедра захисту рослин
Завідувач кафедрою_____________________
А.К.Мішньов
ДИПЛОМНА РОБОТА
на тему: «Біохімія трансгенної картоплі в умовах
України»
Для одержання кваліфікації спеціаліста
за спеціальністю 7.130105 – Захист рослин»
Виконавець _________________ (ЗагорулькоО.)
Науковий керівник ______________ (Чіванов В.Д.)
Консультант з екологічної
експертизи ________________ (Жатова Г.О.)
Консультант з питань
техніки безпеки_________________ (Шандиба О.Б.)
Суми - 2001
ЗМІСТ
Стор.
Вступ..................................................................................................................
1. Огляд літератури…………………………………………………………….
1.1. Загальна характеристика фізико-хімічних властивостей глікоалкалоїдів
рослин родини Solanaceae................................………………………………
1.1.1. Глікоалкалоїди рослин картоплі та їх будова………………………….
1.1.2. Глікоалкалоїди як токсичні сполуки……………………………………
1.1.3. Роль глікоалкалоїдів в явищі імунітета до бактеріальних, грибкових захворювань і шкідників та їх значення в селекції нових сортів
картоплі……………………………………………………………………
2. Природні умови господарства......................................................................
3. Методика проведення досліджень..............................................................
4. Результати досліджень.................................................................................
5. Охорона праці...............................................................................................
6. Охорона навколишнього середовища.......................................................
Висновки..........................................................................................................
Список використаної літератури...............................................................
ВСТУП
Підвищений “тиск” на організм людини ксенобіотичних сполук природного та штучного походження обумовлює необхідність поглибленого вивчення таких сполук, і в першу тих із них, котрі входять до складу найбільш поширених харчових продуктів, зокрема картоплі. Глікоалкалоїди картоплі являють собою групу вторинних метаболітів, яким притаманні найрізномантніші види біологічної активності ( ). Так, дослідами in vitro доведена здатність цих сполук спричинювати хромосомні аберації, порушувати цілісність ліпосом та природніх біомембран тощо ( ). Останнє свідчить на користь того, що глікоалкалоїдам притаманна потенційна мутагенна і, можливо, канцерогенна активність ( ). Виходячи з наведеного, цілком природньою є підвищена зацікавленість в дослідженні глікоалкалоїдів з боку фахівців в галузях медичної токсикології і генетики людини, тим більше, що в останні роки на світовий ринок виходять нові сорти продовольчої картоплі, отриманої як шляхом “класичної” селекції за участі дикоростучих видів роду Solanum ( ), так і за допомогою генетичної інженерії (New LeafÒ, Monsanto, США). Обидва підходи не виключають біосинтезу в тканинах рослин картоплі, зокрема бульбах, окрім характерних для культурної картоплі глікоалкалоїдів a-Соланіну та a-Чаконіну “мінорних” глікоалкалоїдів (солакаулін, соласолін, соламаргін, деміссін, томатін, лептін І і ІІ, лептінін-І і ІІ тощо), які ведуть походження з дикоростучих попередників, або синтезуються de novo ( ). Останнім притаманні токсикологічні характеристики, відмінні від добре відомих аналогічних показників a-Соланіну та a-Чаконіну. Якщо прийняти до уваги встановлений факт щодо синергетичного багаторазового підсилення біологічної активності суміші двох різних за хімічною структурою глікоалкалоїдів ( ), то стає цілком обгрунтованою необхідність досліджень кількісних та якісних показників глікоалкалоїдів продовольчої картоплі паралельно з селекцією та молекулярною інженерією, успішність яких залежить від наявності нових високочутливих методів фізико-хімічного аналізу. Складність аналізу сумарної фракції глікоалкалоїдів з рослин картоплі пов’язана, зокрема з тим, що субфракція “мінорних” глікоалкалоїдів не перевищує за масою 0,5-5% ( ).
Останнім часом в аналізі біомолекул набули широкого розповсюдження методи м’якоіонізаційної мас-спектрометрії, зокрема плазмено-десорбційна мас-спектрометрія (PDMS). Зважаючи на це, нами зроблена спроба проаналізувати фракцію глікоалкалоїдів бульб та квітів картоплі трансгенних сортів NewLeaf 6 Russet Burbank та NewLeaf 6 Atlantic за допомогою PDMS мас-спектрометрії. Таким чином, метою наших досліджень був докладний аналіз глікоалкалоїдів бульб та квітів картоплі трансгенних сортів NewLeaf 6 Russet Burbank та NewLeaf 6 Atlantic новітнім мас-спектрометричним методам.
ОГЛЯД ЛІТЕРАТУРИ
1.1. Загальна характеристика фізико-хімічних властивостей глікоалкалоїдів рослин родини Solanaceaе
Рослини картоплi культурних та диких видів мiстять серед численних органiчних сполук групи вторинних метаболітів глiкоалкалоїди ( ), найважливiшими з яких є a-соланiн, a-чаконiн, деміссин, лептіни I,II,III, соламарін, коммерсонін ( ). Фiзiологiчнi функцii глiкоалкалоїдiв пов'язанi з явищем стiйкостi рослин картоплі проти фiтопатогенiв i шкiдникiв ( ). Крiм того, глiкоалкалоїди беруть безпосередню участь в бiохiмiчних процесах, які притаманні тканинам листкiв, пагонiв, квiток, бульб рослин картоплi (цвiтiння, видова сумiснiсть, утворення насiння); обумовлюють разом з iншими вторинними метаболiтами смаковi якостi та придатнiсть картоплi для переробки ( ), а також мають певне значення як токсичні, ембріотропні і канцерогеннi сполуки природнього походження ( ). Зважаючи на це, багато перспективних за врожайнiстю та iншими господарсько-корисними якостями сортiв картоплi не були рекомендованi для широкого використання саме завдяки пiдвищеному вмiсту глiкоалкалоїдiв ( ). На думку вiтчизняних та зарубiжних ( ) дослiдникiв, кiлькiснi та якiснi характеристики глiкоалкалоїдiв нових сортiв i гiбридiв картоплi заслуговують на поглиблене вивчення. Одним з найважливіших питань, пов’язаних з біохімією та фізіологією глікоалкалоїдів, яке і досі не знайшло однозначного вирішення, є встановлення корелятивних зв’язків між параметрами метаболізму глікоалкалоїдів та ступенем стійкості сортів картоплі проти шкідників і фітопатогенів ( ). Іншим дискусійним питанням є невизначеність зв’язків між кількісним накопиченням глікоалкалоїдів в тканинах рослин картоплі різних сортів, зокрема бульбах і умовами вирощування (погодно-кліматичні умови протягом конкретного вегетаційного сезону, тип грунтів, удобрення тощо), а також умовами зберігання (температура, освітленість, вологість тощо)( ). На думку провідних вчених дискусійні та суперечливі результати в цьому напрямку дослідження отримані тому, що, по-перше, на інтенсивність біосинтезу вторинних метаболітів взагалі і глікоалкалоїдів зокрема, різноспрямовано впливає велика кількість факторів зовнішнього середовища і це, разом з підвищеною лабільністю та чутливістю ферментних систем метаболізму глікоалкалоїдів до зазначених факторів обумовлює суттєві розбіжності, про які згадувалось вище; і, по-друге, більшість ранніх робіт були проведені без урахування різноманітності глікоалкалоїдів за хімічною структурою – в межах цих досліджень визначали тільки їх сумарну кількість ваговим або колориметричним методами ( ).
Проте, глікоалкалоїди картоплі являють собою досить велику групу сполук, до складу якої входять «мажорні» (a-соланiн та a-чаконiн у культурних видів картоплі) і численні «мінорні» (b-соламарін, деміссидін, 5b-соланідан-3a-ол, томатіденол) компоненти. Крім того, тканини рослин картоплі містять спеціалізовані ферментні системи, які модифікують інтактні молекули глікоалкалоїдів з утворенням численних проміжних сполук, фізіологічна роль яких вичерпно не з’ясована (b-соланін, b-чаконін, g-соланін, g-чаконін тощо)( ). Таким чином, дослідження статичних і динамічних кількісних та якісних параметрів глікоалкалоїдів рослин картоплі різних сортів в процесах вирощування в умовах конкретних кліматичних зон, зберігання та переробки, а також під впливом фітопатогенів, мають певні перспективи за умов використання з метою аналізу цих сполук нових високоінформативних фізико-хімічних методів досліджень ( ). В Сумському ДАУ та Інституті прикладної фізики НАНУ (м.Суми) в 1994-2000 рр. в межах проекту «М’якоіонізаційна мас-спектрометрія в агробіології» провели цикл досліджень глiкоалкалоїдів рослин картоплi за допомогою новiтнього фiзико-хiмiчного методу аналізу полярних, термолабільних, нелетючих органiчних сполук – плазмено-десорбційної часопрольотної плазмено-десорбцiйної мас-спектрометрiї з iонiзацiєю уламками подiлу 252Cf (МС-ПДМС)( ).
Алкалоїди являють собой велику групу рослинних речовин різного хімічного складу, яким притаманна специфічна дія на організм ссавців та людини. Алкалоїди є азотовміськими гетероциклічними сполуками, що містять в своєму складі атом азоту. Загальною властивостю даної групи речовин є їх надзвичайно сильна фізиологічна дія на організм тварин та людей. Більшість алкалоїдів діють на нервову систему: в невеликих дозах здійснюють збуджуючий вплив, в великих - пригнічують, а в ще більших є сильнодіючими отрутами ( ). Фізіологічне значення алкалоїдів в життєдіяльності самих рослин досі не з`ясовано. До цього часу не вдалося ще з великою достовірностю показати місце алкалоїдів в життєво важливих процесах обміну речовин, з іншого боку немає неспростовних доказів того, що алкалоїдоносні види рослин можуть існувати без алкалоїдів ( ).
В ряді робіт відзначається вплив алкалоїдів на обмін речовин у рослин, виникнення квітів, формування органел та органів рослин, ріст клітин, поділ ядер і т.д. Було доведено, що алкалоїди в клітинах рослин якимось чином ізольовані від внутрішнього середовища клітини. Так, розчини нікотину, нанесені на рослинні тканини табаку, чинять всебічну негативну фітотоксичну дію навіть при концентрації, рівній їх концентрації в тканинах. Доведено, що високий вміст алкалоїдів часто пов`язаний зі зниженням сили росту рослин. Інакше кажучи, у рослин в період вегетації та спокою існує тісний взаємозв`язок: «білковий азот - алкалоїди». Цими причинами, на думку Горяєва, пояснюється зміна складу алкалоїдів, а в деяких випадках і їх повна відсутність в тканинах алкалоїдних рослин (Solsola richteri. Girgensonia Oppositiflora. Anabasis turkestanika) ( ).
1.1. 1. Глікоалкалоїди рослин картоплі та їх будова.
Глікоалкалоїди, які містяться в бульбах картоплі, раніше називали загальним терміном «соланін». В наш час встановлено, що так званий «соланін» являє собою суміш якнайменше 6 різних глікозідних сполук: a-, b-, g-соланіна та a-, b-, g-чаконіна. Ці сполуки мають один і той же аглікон («корове ядро») – соланідин і відрізняються між собою складом глікозидного ланцюжка (Рис.1). Трисахаріди - a-соланін і a-чаконін є основними формами і складають в тканинах картоплі біля 95% усієї суми глікоалкалоїдів групи соланіна ( ). Крім a-, b-, g-соланіна та a-, b-, g-чаконіна, відомі інші глікоалкалоїди пасльонових: солакаулін, соласолін, соламаргін, демісін, томатін, лептін, лептінін-1, лептінін-2 та інші. Всі гликоалкалоїди складаються з двох основних складових, виникаючих при кислотному гідролізі цих речовин – аглікона, який і є власне «алкалоїдом», і декількох моносахарів, які знаходяться в молекулі глікоалкалоїда в вигляді глікозідного ланцюга, зв`язаного з агліконом ( ). Глікоалкалоїди культурної та дікої картоплі (Solanum) можна систематизувати в окремі групи. До групи соланідіна відносяться: a-, b-, g-соланін та a-, b-, g-чаконін, солакаулін і глікоалкалоїд, виділений з групи Akaulia. Іншу групу алкалоїдів складають сполуки, агліконом яких є соласодін. Сюди входять соласонін і соламаргін. Соласонін і соламаргін є основними алкалоїдами Solanum nigrum, Solanum laciniatum більшості інших видів Solanum
( ).
Соласодамін знайдений в листках Solanum auriculatum і Solanum magrinatum. В групу, яка містить в якості аглікона демісідін, входить демісин, знайдений у Solanum demissum і глікоалкалоїд, виділений із Solanum polyadenium. Лептіни – глікоалкалоїди,
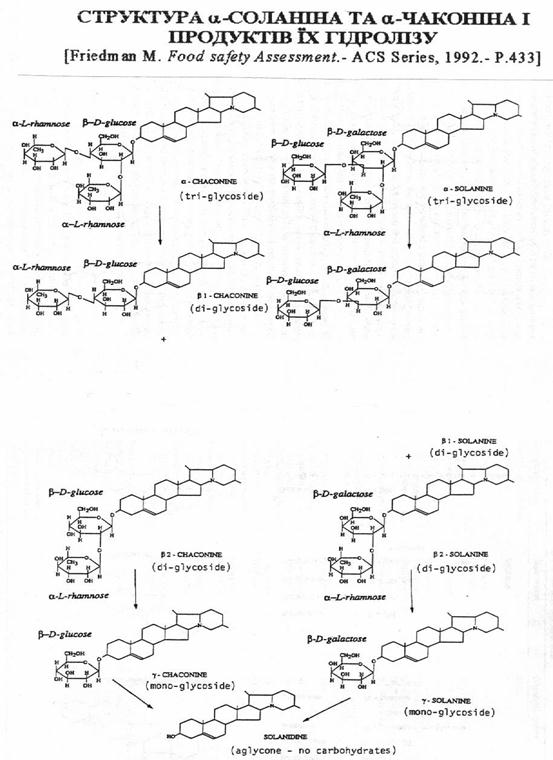
Рис.1. Хімічна структура агліконів, знайдених в рослинах картоплі ( ).
знайдені Куном і Левом, виявлені у Solanum chacoense. Групи Eutuberosa, Andigena, і Commersonia містять тільки - соланін, ці види містять також чаконін. Ці два глікоалкалоїди зустрічаються завжди разом, що доведено хроматографічними дослідженнями. Демісин присутній в рослинах групи Demissa і Acaulia, за виключенням Solanum acaulia, в складі якого знайдено солакаулін. Демісин знайдений також у Solanum jamesii. У форм, які не дають бульб, крім a-соланіна, який і тут частіше всього зустрічається, найбільшу групу складають форми, які містять томатін. І тільки єдина форма Solanum poliadenium, яка створює бульби, містить томатін. Інші алкалоїди зустрічаються тільки в деяких форм, нприклад, соласодамін – у Solanum sodomaneum i Slanum aviculare.
Всі алкалоїди картоплі належать до стероїдної групи похідних циклопентанопергідрофенантрена і складаються з алкалоїда (аглікона) та цукру, зв’язаного з ним глікозідним зв’язком. Аглікон має стероїдну будову, містить атоми азоту, який утворює третинну або вторинну аміногрупу. Прикладом першого типу являється соланідін, другого-томатідін і соласодін. Глікозідна частина являє собою моно-, ді-, три-, і тетрасахаріди; до їх складу може входити глюкоза (Glu), галактоза (Gal), рамноза (Rha) і ксілоза (Xyl). Наприклад, a-соланін складається з аглікона-соланідіна і трисахаріда, який при гідролізі кислотою розпадається на галактозу, глюкозу і рамнозу. Соланін має розгалужений сахарний ланцюжок: безпосередньо з агліконом зв`язана галактоза, а глюкоза і рамноза складають бокові ланцюги. Подібну будову мають глікозідні частини глікоалкалоїдів демісіну, томатіну, a-чаконіну, соласодіну і соламаргіну ( ).
Під впливом гідролізу глікоалкалоїди розпадаються на цукор і аглікон, фізичні і хімічні властивості якого і вказують на велику схожість його зі стероїдами. Стероїди утворюють різноманітну групу важливих природних речовин. Сюди відносяться стеріни, жовчні кислоти, гормони розмноження, вітаміни групи Д, глікозиди, різні алкалоїди і інші речовини. Базовою структурою усіх стероїдів є стеран (циклопентанопергідрофенантрен).
До класу стероїдів належать також фітостерини: сіто-, стігма-, і кампестерін, холестерін, ергостерін, жовчні кислоти.
Сполуки стероїдів з сахаром належать до групи глікозідів. В цю групу, крім глікоалкалоідів, входять «сердечні глікозіди», які містяться в деяких рослинах із родини Strophanthus і Digitalis. Стероїдні саконіни також являють собою глікозіди агліконів, котрі э похідними циклопентанопергідрофенантрена. Сапоніни не містять в своєму складі атом азоту ( ).
Одним з доказів схожості аглікона глікоалкалоідів зі стероїдами є те, що їх можливо перетворити в метилциклофенантрен. Ця сполука синтезується тим же шляхом із стероїдів. При третьому атомі вуглецю аглікона знаходиться група, яка може сполучатися глікозідно з моносахаридами. Остаточно стероїдну будову аглікона вдалося довести, коли похідне аглікона отримали з відомих стероїдів і, навпаки, похідні стероїдів- із аглікона глікоалкалоїдів
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Белок - основа жизни
Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многообразными функ
- Билеты и ответы по биологии. 9 класс (анатомия)
По учебнику «Биология. Человек.» А.С.Батуев, И.Д. Кузьмина.Билет №1.1. Что изучает анатомия человека? Назовите другие науки, изучающие чел
- Билеты по биологии для 8 класса
№1.1)Туловище собаки стройное и мускулистое. Её конечности располагаются под туловищем, поэтому тело животного не касается земли. Ходит
- Билеты по биологии 11 класс
Билет № 11. 1. Клеточное строение организмов. Клетка — единица строения каждого организма. Одноклеточные организмы, их строение и жизнед
- Биологические особенности двоякодышащих и кистепёрых рыб
НАДОТРЯД ДВОЯКОДЫШАЩПЕ (DIPNOІ, ИЛИ DIPNEUSTOMORPHA) ОТРЯД РОГОЗУБООБРАЗНЫЕ(CERATODIFORMES)Рогозубообразные — единственная дожившая до нашего времени
- Биологическое окисление
УРАЛЬСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯКафедра биоорганической и биологической химииКУРСОВАЯ РАБОТА НА ТЕМУ:Биологическое ок
- Биология и экология обыкновенного и гребенчатого тритонов
Изучение экосистем является сегодня одной из самых актуальных проблем. Она подразделяется на ряды стадий, одна из них - изучение отдельн
 www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

