Масс-спектрометрический метод анализа
ЧЕЛЯБИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
Курсовая работа на тему
«Масс-спектрометрический метод анализа»
Выполнил: студент группы Х-202
Меньшенин А.Н.
Проверила: Данилина Е.И.
Челябинск
2007
Содержание
1. ВВЕДЕНИЕ
2. Основы масс-спектрометрии
3. Принципиальное устройство масс-спектрометра
4. Способы ввода образца
5. Механизмы ионизации
6. Протонирование
7. Депротонирование
8. Катионизация
9. Прямой перенос заряженной молекулы в газовую фазу
10. Отрыв электрона
11. Захват электрона
12. Способы ионизации
13. Ионизация электроспрея (ESI)
14. Растворители для электроспрея
15. Устройство прибора ионизации электроспрея
16. Ионизация наноэлектроспрея (nanoESI)
17. Химическая ионизация при атмосферном давлении (APCI)
18. Фотоионизация при атмосферном давлении (APPI)
19. Лазерная десорбция/ионизация при помощи матрицы (MALDI)
20. Преимущества и недостатки метода лазерной десорбции/ионизации при помощи матрицы (MALDI).
21. Десорбция/ионизация на кремнии (DIOS)
22. Бомбардировка быстрыми атомами/ионами (FAB)
23. Электронная ионизация (EI)
24. Химическая ионизация (CI)
25. Сравнение основных характеристик способов ионизации
26. Анализаторы масс
27. Анализ масс
28. Краткий обзор принципов работы анализаторов
29. Рабочие характеристики анализаторов
30. Точность
31. Разрешение (разрешающая сила)
32. Диапазон масс
33. Тандемный анализ масс (MS/MS или MSn)
34. Скорость сканирования
35. Конкретные виды анализаторов
36. Квадрупольный анализатор
37. Квадрупольная ионная ловушка
38. Линейная ионная ловушка
39. Ограничения ионной ловушки
40. Двуфокусирующий магнитный сектор
41. Квадрупольная-времяпролётная тандемная масс-спектрометрия
42. MALDI и времяпролётный анализ
43. Квадрупольная времяпролётная масс-спектрометрия
44. Масс-спектрометрия с Фурье-преобразованием (FTMS)
45. Общее сравнение анализаторов масс, обычно используемых совместно с ES
46. Детекторы
47. Электронный умножитель
48. Цилиндр Фарадея
49. Фотоумножитель с преобразующим динодом
50. Матричный детектор
51. Зарядовый (индуктивный) детектор
52. Общее сравнение детекторов.
53. Вакуум масс-спектрометра
Список использованной литературы
ВВЕДЕНИЕ
Масс-спектрометрию описывали как мельчайшие весы в мире, не из-за размера масс-спектрометра, но из-за того, что он взвешивает – молекулы. За последнее время масс-спектрометрия претерпела потрясающий технологический подъём, позволяющий применять её для белков, пептидов, углеводов, ДНК, лекарств и многих других биологически активных молекул. Благодаря таким способам ионизации, как ионизация электроспрея (ESI) или лазерная десорбция/ионизация из матрицы (MALDI), масс-спектрометрия стала незаменимым инструментом для биохимических исследований.
Основы масс-спектрометрии
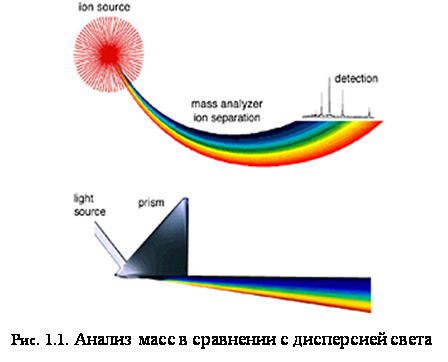
Масс-спектрометр определяет массу молекулы, измеряя отношение массы к заряду (m/z) её иона. Ионы генерируются при потере или получении заряда нейтральными частицами. После образования ионы электростатически направляются в анализатор массы, где они разделяются соответственно своему m/z и, наконец, детектируются. Результатом ионизации молекул, разделения ионов и детектирования ионов является спектр, по которому можно определить молекулярную массу и даже некоторую информацию о строении вещества. Можно провести аналогию между масс-спектрометром и призмой, как показано на рис. 1.1. В призме свет разделяется на компоненты по длинам волн, которые затем определяются оптическим рецептором. Точно так же, в масс-спектрометре сгенерированные ионы разделяются в анализаторе массы, подсчитываются и определяются в детекторе ионов (таких, как, например, электронный умножитель).
Четыре базовых компонента являются стандартными для большей части масс-спектрометров (рис. 1.2): система ввода образца, устройство иониза-
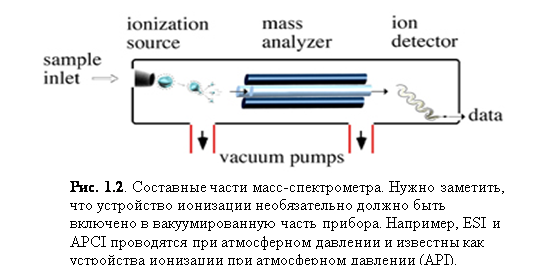
ции, анализатор массы и детектор ионов. Некоторые приборы комбинируют ввод образца и ионизацию, в других объединены анализатор массы и детектор. Однако все молекулы образца претерпевают одинаковые воздействия независимо от конфигурации прибора. Молекулы образца вводятся через систему впуска. Попав внутрь прибора, молекулы преобразуются в ионы в устройстве ионизации, а затем электростатически переносятся в анализатор массы. Ионы затем разделяются соответственно их m/z. Детектор преобразует энергию ионов в электрические сигналы, которые затем поступают в компьютер.
Способы ввода образца
Ввод образца был одной из первых проблем в масс-спектрометрии. Для проведения анализа масс образца, который первоначально находится при атмосферном давлении (760 Торр), он должен быть введён в прибор таким образом, чтобы вакуум внутри последнего остался практически неизменным (~10-6 Торр). Основными методами ввода образца являются прямое введение
зонда или подложки, обычно используемое в MALDI-MS, или прямое вливание или впрыскивание в устройство ионизации, как в методе ESI-MS. (1)
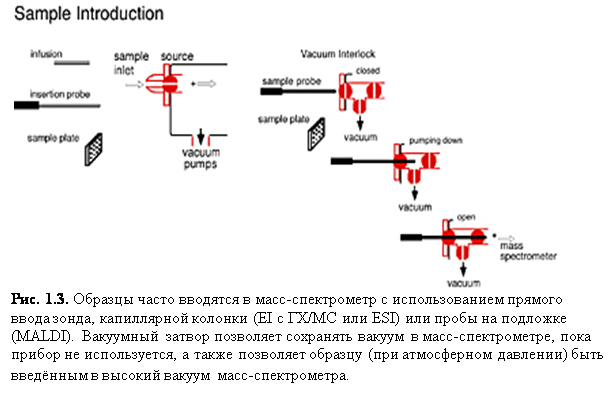
Прямое введение: использование прямого введения зонда/подложки (рис. 1.3) – очень простой способ доставки образца в прибор. Образец сначала размещается на зонде, а затем вводится в ионизационную зону масс-спектрометра, обычно через вакуумный клапан. Образец после подвергается необходимым процедурам десорбции, таким как лазерная десорбция или прямое нагревание, чтобы обеспечить испарение и ионизацию.
Прямое вливание или впрыскивание: простой капилляр или капиллярная колонка используется для помещения образца в газообразной форме или в растворе. Прямое вливание также удобно, потому что оно позволяет эффективно вводить малые количества вещества в масс-спектрометр без нарушения вакуума. Капиллярные колонки обычно используются для разграничения систем разделения и устройства ионизации масс-спектрометра. Эти системы, включая газовую хроматографию (ГХ) и жидкостную хроматографию (ЖХ), также служат для разделения различных компонентов раствора, важных для анализа масс. В газовой хроматографии разделение различных компонентов происходит в стеклянной капиллярной колонке. Как только пары образца покидают хроматограф, они направляются прямиком в масс-спектрометр.
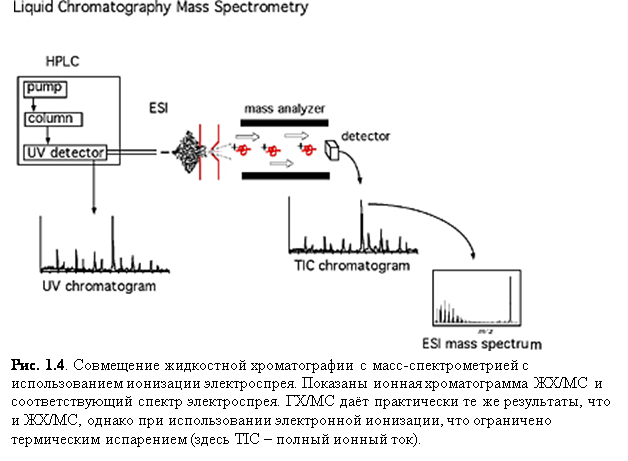
В 1980-х годах невозможность совместного использования жидкостной хроматографии (ЖХ) с масс-спектрометрией была обусловлена, большей частью, неспособностью устройств ионизации справляться с непрерывным по-
током ЖХ. Однако, ионизация электроспрея (ESI), химическая ионизация при атмосферном давлении (APCI) и фотоионизация при атмосферном давлении (APPI) сейчас позволяют совмещать ЖХ и масс-спектрометрию в повседневных анализах.
Механизмы ионизации
Протонирование – механизм ионизации, при котором к молекуле присоединяется протон, сообщая ей заряд 1+ на каждый присоединённый протон. Положительные заряды обычно локализуются на основных частях молекулы, таких, как амины, с образованием стабильных катионов. Пептиды часто ионизируются при помощи протонирования. Протонирование осуществляется при MALDI, ESI и APCI.
Депротонирование– механизм ионизации, при котором отрицательный заряд 1- получается при отрыве протона от молекулы. Такой механизм ионизации обычно осуществляется при MALDI, ESI и APCI и очень полезен для определения кислотных образцов, включая фенолы, карбоновые кислоты и сульфоновые кислоты. Спектр отрицательных ионов сиаловой кислоты показан на рис 1.2.
Катионизация– механизм ионизации, в котором заряженный комплекс образуется при координационном присоединении положительно заряженного иона к нейтральной молекуле. В принципе, пртонирование тоже подпадает под это определение, поэтому катионизацией считается присоединение иона, отличного от протона, например щелочного металла или аммония. Кроме того, катионизация применима к молекулам, которые неспособны к протонированию. Связь катионов, в отличие от протонов, с молекулой менее ковалентна, поэтому заряд остаётся локализован на катионе. Это минимизирует размывание заряда и фрагментацию молекулы. Катионизация также может быть произведена при MALDI, ESI и APCI. Углеводы – лучшие вещества для такого механизма ионизации, с Na+ как обычным присоединённым катионом.
Прямой перенос заряженной молекулы в газовую фазу
Перенос соединений, уже заряженных в растворе, легко достигается при использовании десорбции или выбрасыванием заряженных частиц из конденсированной фазы в газовую. Обычно это осуществляется с использованием MALDI или ESI.
Отрыв электрона
Как видно из названия механизма, отрыв электрона придаёт молекуле 1+ положительный заряд при выбивании электрона, так что при этом часто образуются катион-радикалы. Наблюдаемый, в основном, при электронной ионизации, отрыв электрона обычно применяется для относительно неполярных соединений с низкой молекулярной массой. Также известно, что он часто приводит к образованию значительных количеств фрагментарных ионов.
Захват электрона
При захвате электрона, отрицательный заряд 1- сообщается молекуле при присоединении электрона. Этот механизм ионизации в первую очередь наблюдается для молекул с большим сродством к электрону, таких как галогенсодержащие соединения.
Таблица 1.1. Механизмы ионизации, их преимущества и недостатки.
Механизм ионизации | Преимущества | Недостатки |
| Протонирование (положительные ионы) | · многие соединения присоединяют протон с получением заряда · многие способы ионизации, такие, как ESI, APCI, FAB, CI и MALDI производят такие частицы | · многие соединения нестабильны в протонированной форме (например, углеводы) или с трудом присоединяют протон (например, углеводороды) |
| Катионизация (положительные ионы) | · многие соединения присоединяют катион, такой как Na+ или K+ с получением заряда · многие способы ионизации, такие, как ESI, APCI, FAB и MALDI производят такие частицы | · опыты тандемной масс-спектрометрии на катионизированных молекулах часто дают очень ограниченную информацию по фрагментации |
| Депротонирование (отрицательные ионы) | · многие полезные вещества в какой-то мере являются кислотами · многие способы ионизации, такие, как ESI, APCI, FAB и MALDI производят такие частицы | · применимо только для специфических соединений |
| Перенос заряженных молекул в газовую фазу (положительные и отрицательные ионы) | · полезно для соединений, которые уже заряжены · многие способы ионизации, такие, как ESI, APCI, FAB и MALDI производят такие частицы | · применимо только для уже заряженных частиц |
| Отрыв электрона (положительные ионы) | · наблюдается при электронной ионизации и даёт информацию не только о молекулярной массе, но и информацию о фрагментарных ионах | · часто производит слишком сильную фрагментацию · может быть непонятно, является ли ион с наибольшей массой молекулярным ионом или же фрагментом |
| Захват электрона (отрицательные ионы) | · наблюдается при электронной ионизации и даёт информацию не только о молекулярной массе, но и информацию о фрагментарных ионах | · часто производит слишком сильную фрагментацию · может быть непонятно, является ли ион с наибольшей массой молекулярным ионом или же фрагментом |
Способы ионизации
Вплоть до 1980-х электронная ионизация (EI) была основным способом ионизации для анализа масс. Однако EI ограничивала химиков и биохимиков малыми молекулами, масса которых намного ниже массы большинства биоорганических соединений. Это ограничений побудило таких учёных, как Дж. Б. Фенн, К. Танака, Ф. Хилленкамп, М. Карас, Г. Кукс и М. Барбер, разработать новое поколение способов ионизации, включая бомбардировку быстрыми атомами/ионами (FAB), лазерную ионизацию при помощи матрицы (MALDI) и ионизацию электроспрея (таблица 1.2). Эти способы совершили революцию в биомолекулярном анализе, особенно для больших молекул. Среди них, ESI и MALDI стали по-настоящему «избранными», когда дело касается биомолекулярного анализа.
Таблица 1.2.
Способ ионизации | Аббревиатура | События |
| Ионизация электроспрея | ESI | испарение заряженных капель |
| Ионизация наноэлектроспрея | nanoESI | |
| Химическая ионизация при атмосферном давлении | APCI | коронный разряд и перенос протона |
| Лазерная десорбция/ионизация при помощи матрицы | MALDI | поглощение фотона/перенос протона |
| Десорбция/ионизация на кремнии | DIOS | |
| Бомбардировка быстрыми атомами/ионами | FAB | десорбция иона/перенос протона |
| Электронная ионизация | EI | пучок электронов/перенос электрона |
| Химическая ионизация | CI | перенос протона |
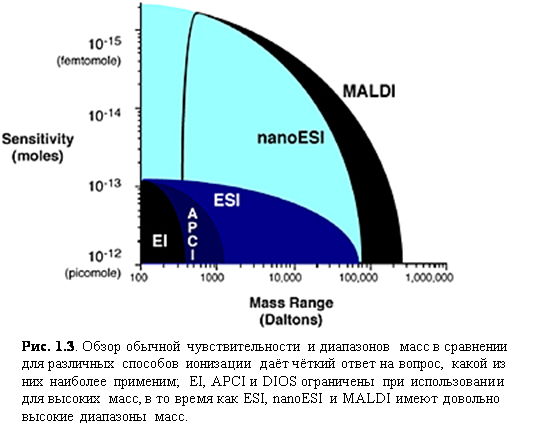 |
MALDI и ESI сейчас являются самыми распространёнными способами ионизаций для биомолекулярной масс-спектрометрии, с их превосходными диапазонами масс и чувствительностью (рис. 1.3). Следующий раздел будет посвящён основам способов ионизации, рассматривая некоторые детали в практических аспектах их применения наряду с механизмами ионизации.
Ионизация электроспрея (ESI)
Идея электроспрея, хоть и не нова, была возрождена в связи с её настоящим применением к биомолекулам. Первые эксперименты с электроспреем были проведены Чепменом в поздних 1930-х, а практическое развитие ионизации электроспрея для масс-спектрометрии было завершено Доулом в поздних 1960-х. Доул также открыл важное явление множественной зарядки молекул. Работы Фенна окончательно привели к современной технике ионизации электроспрея в масс-спектрометрии и её применению для биологических молекул.
Суть ESI заключается в следующем. Электрическое напряжение на игле приводит к большому электрическому градиенту на жидкости, который разделяет заряды на поверхности. Это вынуждает жидкость выпячиваться с иглы в форме конуса Тейлора. Верхушка конуса вытягивается в нить до тех пор, пока не достигнет предела Рэлея, при котором поверхностное натяжение и электростатическое отталкивание сравняются и сильно заряженная капля не оторвётся от нити. Капли, которые оторвались от конуса, притягиваются к входу в масс-спектрометр из-за большой разности потенциалов между иглой и входом в масс-анализатор. По мере продвижения капли к анализатору кулоновское отталкивание на поверхности превосходит поверхностное натяжение и капля «взрывается», окончательно высвобождая ионы.(3)
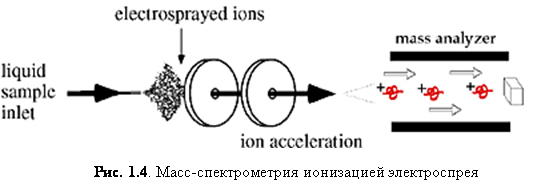
Ионизация электроспрея – метод, который обычно применяется для пептидов, белков, углеводов, малых олигонуклеотидов, синтетических полимеров и липидов. ESI производит газообразные заряженные молекулы прямо из жидкого раствора. Ионизация происходит при создании тонкого спрея сильно заряженных капель в присутствии электрического поля. Образец раствора распыляется из области с сильным электрическим полем на конце металлической форсунки, поддерживаемой при потенциале между 700 и 5000 В. Форсунка (или игла), к которой приложен потенциал, служит для распыления раствора в тонкий спрей заряженных капель. Использование сухого газа, нагревания или оба этих способов применяется к заряженным каплям при атмосферном давлении для испарения из них растворителя. С уменьшением размера капель возрастает плотность заряда на их поверхности. Взаимное кулоновское отталкивание между одинаковыми зарядами на этой поверхности становится настолько велико, что превосходит силы поверхностного натяжения и ионы вырываются из капли через «конус Тейлора» - рис. 1.5. Другая возможность состоит в том, что капля взорвётся, высвобождая ионы. В любом случае свободные ионы направляются в канал через электростатические «линзы», направляясь в вакуум масс-анализатора. Так как ESI включает в себя непрерывную подачу раствора, он применим для использования совместно с ВЭЖХ или капиллярным электрофорезом.(4)
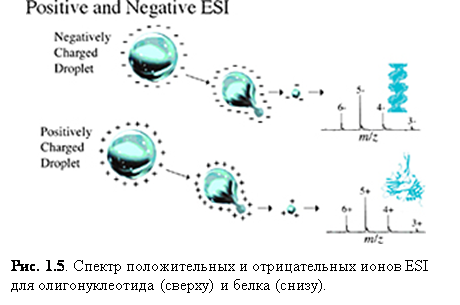 |
Ионизация электроспрея благоприятствует образованию единично заряженных малых молекул, но также хорошо известно образование в ходе неё многократно заряженных экземпляров больших молекул. Это важное явление, т.к. масс-спектрометр измеряет отношение массы к заряду (m/z) и поэтому многократная зарядка делает возможным наблюдать очень большие молекулы при помощи инструмента с относительно малым диапазоном масс. К счастью, программы, пригодные для всех масс-спектрометров с электроспреем, позволяют произвести вычисления молекулярной массы, необходимые для определения действительной массы многозарядных образцов. Рис. 1.6 и 1.7 показывают различные заряженные состояния двух различных белков, где каждый пик в масс-спектрах может быть соотнесён с различными зарядовыми состояниями молекулярного иона. Многократная зарядка имеет другие важные преимущества в тандемной масс-спектрометрии. Одно из преимуществ состоит в том, что после фрагментации вы наблюдаете больше фрагментарных ионов от многозарядного предшественника, чем от однозарядного.
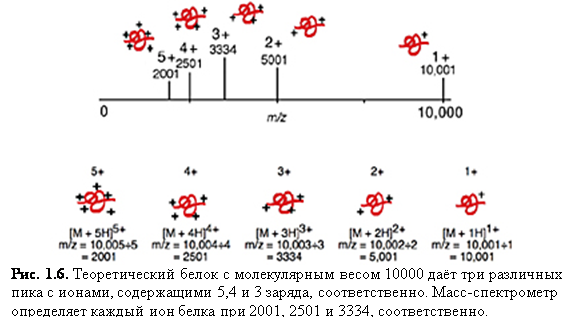
Многократная зарядка: белок с массой 10000 дальтон и его теоретический масс-спектр с зарядами до +5 показаны на рис. 1.8. Масса белка остаётся такой же в то время, как отношение m/z меняется в зависимости от числа зарядов на белке. Ионизация белка есть обычно результат протонирования, что не только добавляет заряд, но также увеличивает массу белка на число добавленных протонов. Это действие на m/zприменимо одинаково для любого механизма ионизации молекулы, образовавшего положительно или отрицательно заряженный молекулярный ион, включая присоединение или отрыв несущих заряд частиц, отличных от протона (например, Na+ и Cs+). Многократные положительные заряды наблюдаются для белков, в то время как для олигонуклеотидов типично образование отрицательных зарядов (с ESI).
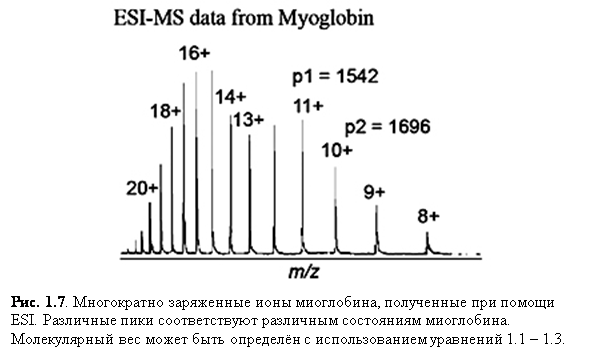 |
Хотя масс-спектрометры электроспрея снабжены программами, которые подсчитывают молекулярный вес, понимание, как компьютер производит эти вычисления для многократно-заряженных ионов полезно. Уравнения 1.1 – 1.5 и рис. 1.9 представляют простое объяснение, где мы принимаем, что пики p1 и p2 являются соседними и различаются одним зарядом, что эквивалентно добавлению одного протона.
p = m/z | (1.1) |
p – пик в масс-спектре z – полный заряд | p1 – значение m/z для p1 |
Уравнения 1.2. и 1.3. могут быть решены для двух неизвестных, Mr и z1. Для пиков в масс-спектре миоглобина, показанном на рис. 1.9, p1=1542, p2=1696. | |
1542 z1 = Mr + z1 | (1.4) |
Растворители для электроспрея
Многие растворители могут быть использованы в ESI и выбираются в зависимости от растворимости исследуемых соединений, летучести растворителя и способности растворителя к отдаче протона. Обычно, основными являются протонные растворители, такие, как, метанол, 50/50 метанол/вода или 50/50 ацетонитрил/вода, в то время как апротонные сорастоврители, такие, как 10% ДМСО в воде, а также изопропиловый спирт, используются, чтобы улучшить растворимость для некоторых соединений. Хотя 100% вода и используется в ESI, её относительно низкое давление пара является определяющим фактором чувствительности; лучшая чувствительность получается при добавлении летучего органического растворителя. Некоторые соединения требуют использования чистого хлороформа с добавлением 0.1% муравьиной кислоты для обеспечения ионизации. Такой подход, хоть и менее чувствительный, может быть эффективен для соединений, не растворимых другим образом.(5)
Буферы, такие, как Na+, K+, фосфат и соли представляют проблему для ESI из-за снижения давления пара капель, ведущего к ослаблению сигнала из-за увеличения поверхностного натяжения капель, ведущего к уменьшению летучести. Поэтому летучие буферы, такие, как ацетат аммония, могут быть использованы более эффективно.(6)
Таблица 1.3. Преимущества и недостатки ионизации электроспрея (ESI) | ||||
|
Устройство прибора ионизации электроспрея
Неосевая конфигурация ESI, которая сейчас используется во многих приборах для введения ионов в анализатор (как показано на рис. 1.10), показала себя очень эффективной при использовании с большим потоком жидкости. Основное преимущество такой конфигурации состоит в том, что скорость потока может быть увеличена без засорения или закупоривания входного отверстия. Неосевое распыление важно, потому что вход в анализатор более не насыщается растворителем, тем самым предохраняя капли от попадания во входное отверстие и его загрязнения. Наоборот, только ионы направляются ко входу. Это делает ESI ещё более совместимым с ЖХ при скоростях до мл/мин.
Ионизация наноэлектроспрея (nanoESI)
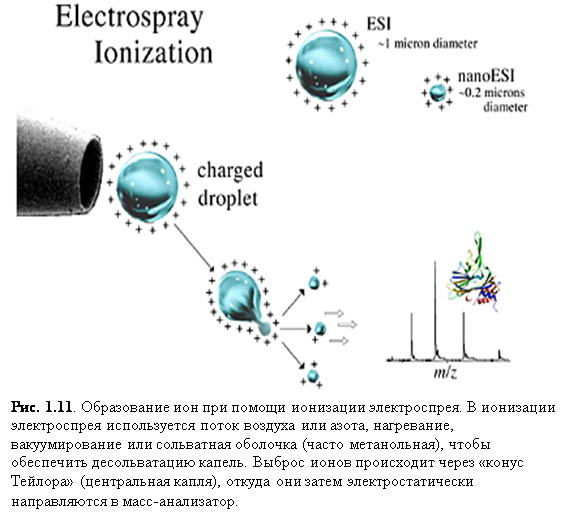 |
Электроспрей низкого потока, впервые описанный Вильмом и Манном, называли наноэлектроспреем, наноспреем и микроэлектроспреем. Такой способ ионизации является вариацией ESI, в которой игла спрея сделана очень
маленькой и расположена близко ко входу в масс-анализатор (рис. 1.11). Конечным результатом такой простой корректировки становится увеличение эффективности, которое включает уменьшение необходимого количества образца.
Скорости потока для nanoESI обычно составляют ль десятков до сотен нанолитров в минуту. Чтобы получить такие малые скорости потока, nanoESI использует источники из вытянутого и, в некоторых случаях, металлизированного стекла или плавленого кварца с малым входным отверстием (~ 5 мкм). Растворённый образец вносится в источник и к его концу прикладывается давление порядка 2 атм. Вытекание образца с очень малой скоростью позволяет достигать высокой чувствительности. Также, источники расположены очень близко ко входу в масс-анализатор, поэтому перенос ионов в масс-анализатор намного более эффективен. Например, анализ 5 mM раствора пептида при помощи nanoESI займёт одну минуту, употребив ~50 фемтомоль образца. Такой же эксперимент с обычным ESI за то же время израсходует 5 пикомоль, т.е. в 100 раз больше, чем nanoESI. К тому же, так как капли для nanoESI обычно меньше, чем для обычного ESI (рис. 1.11.), необходимое для образования ионов испарение намного меньше. Следовательно, nanoESI менее чувствительно к солям и другим примесям, т.к. меньшее испарение означает, что примеси не будут концентрироваться так сильно, как при ESI.(7)
Химическая ионизация при атмосферном давлении (APCI)
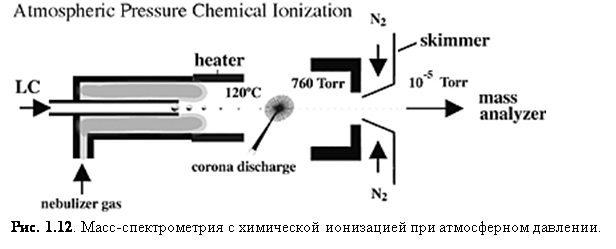
APCI также стала важным способом ионизации, потому что она генерирует ионы непосредственно из раствора и способна к анализу относительно неполярных соединений. Так же, как и в электроспрее, поток жидкости для APCI (рис. 1.12) вытекает непосредственно в устройство ионизации.
Однако сходство здесь заканчивается. Капли не заряжаются и APCI устройство содержите нагретый испаритель, который обеспечивает быстрое разделение/испарение капель. Молекулы образца в паре проходят через зону ионно-молекулярной реакции при атмосферном давлении.
В APCI ионизация возникает из-за возбуждения/ионизации растворителя коронным разрядом. Т.к. ионы растворителя существуют при атмосферном давлении, химическая ионизация молекул аналита очень эффективна; при атмосферном давлении молекулы аналита сталкиваются с ионами реагента очень часто. Перенос протона (для реакций протонирования MH+) образует положительные ионы, а перенос электрона или отщепление протона ((M-H)-) даёт отрицательные. Сглаживающее влияние сольватных оболочек на ионах реагента и высокое давление газа уменьшают фрагментацию во время ионизации и ведут к образованию практически только нетронутых молекулярных ионов. Многократная зарядка обычно не наблюдается, скорее всего, потому что процесс ионизации более энергичен, чем при ESI.(8)
Фотоионизация при атмосферном давлении (APPI)
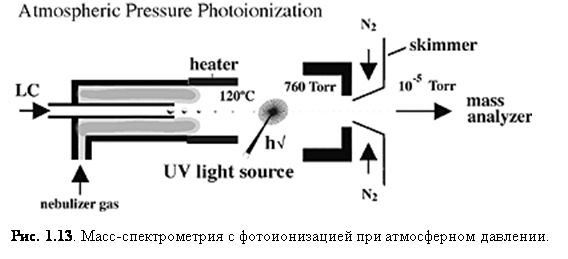
Фотоионизация при атмосферном давлении (APPI) стала сейчас важным способом ионизации, потому что она генерирует ионы непосредственно из раствора с относительно малым фоновым сигналом и способна к анализу относительно неполярных соединений. Так же, как и APCI, поток жидкости для APPI (рис. 1.13) вводится прямо в устройство ионизации.
Основное различие между APCI и APPI состоит в том, что в APPI парообразный образец проходит через ультрафиолетовый свет (обычная криптоновая лампа испускает от 10.0 эВ до 10.6 эВ). Часто APPI является намного более чувствительным, нежели ESI или APCI и показывает более высокое соотношение сигнал/шум из-за более низкой ионизации фона. Низкий сигнал фона во многом обусловлен высоким потенциалом ионизации стандартных растворителей, таких, как метанол и вода (10.85 и 12.62 эВ, соответственно), которые не ионизируются криптоновой лампой.
Недостатком ESI и APCI является то, что они образуют фоновые ионы растворителей. В дополнение к этому, ESI особенно подвержен эффектам подавления ионов, а APCI требует испарения при температурах 350-500°C, что может вызвать термическое разложение.
APPI производит ионизацию двумя механизмами. Первый – простое фотовозбуждение, инициирующее испускание электрона с образованием молекулярного катион-радикала (M+). APPI устройство воздействует светом с энергией выше, чем потенциалы ионизации (ИП) большинства целевых молекул, но ниже, чем ИП для большинства молекул растворителей и воздуха, тем самым исключая их как помехи. К тому же, из-за малой избыточной энергии, сообщаемой молекулам, достигается минимальная фрагментация.
Второй механизм – фотоиндуцированная химическая ионизация при атмосферном давлении, которая похожа на APCI в том, что она включает перенос заряда при протонировании (MH+) или потере протона ((M-H)-).
Для инициирования химической ионизации фотоионизирующийся реагент добавляется к элюенту. После фотоионизации реагента происходит перенос заряда на аналит. Типичными реагентами для положительной ионизации являются ацетон и толуол. Ацетон также служит реагентом для отрицательной ионизации.
Механизм ионизации (M+ или (M+H)+), который претерпевает молекула, зависит от сродства к протону аналита, растворителя и типа используемого дополнительного реагента.(9)
Лазерная десорбция/ионизация при помощи матрицы (MALDI)
Масс-спектрометрия с лазерной десорбцией/ионизацией при помощи матрицы (MALDI-MS) впервые была использована в 1988 году Танакой, Карасом и Хилленкампом. С тех пор он стал широко распространённым методом для пептидов, белков и большинства других биомолоекул (олигонуклеотидов, углеводов, природных веществ и липидов). Эффективный и направленный перенос энергии во время акта индуцированной лазером десорбции при помощи матрицы приводит к большому выходу ионов незатронутого аналита и позволяет проводить измерения соединений с субпикомолярной чувствительностью. Вдобавок, удобство MALDI для анализа гетерогенных образцов делает его очень привлекательным для масс-анализа сложных биологических образцов, как, например, гидролизат белков.

Хотя точный механизм десорбции/ионизации для MALDI неизвестен, принято считать, что MALDI вызывает ионизацию и перевод образца из конденсированной фазы в газовую посредством лазерного возбуждения и индивидуализации молекул образца из матрицы (рис. 1.14). В MALDI анализе аналит сначала сокристаллизуется с большим молярным избытком матричного соединения, обычно УФ-поглощающей слабой органической кислотой. Облучение такой смеси аналита с матрицей лазером приводит к испарению матрицы, которая несёт аналит в себе. Матрица играет ключевую роль в этом методе. Сокристаллизованные молекулы образца также испаряются, но без прямого поглощения энергии лазера. Молекулы, чувствительные к лазерному излучению, поэтому защищены от прямого возбуждения УФ-лазером.
Матрица MALDI – нелетучий твёрдый материал, обеспечивающий процессы десорбции и ионизации посредством поглощения лазерного излучения. Как результат, и матрица, и любой образец, встроенный в неё, испаряются. Матрица также служит для того, чтобы минимизировать ущерб образцу от лазерного излучения, поглощая большую
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Металлорганические соединения
Кафедра: «Органическая химия»Реферат на тему:«Металлорганические соединения»
- Металлы
Металлы – это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которые имеют м
- Металлы
Общая характеристика металлов.Металлы – это элементы, проявляющие в своих соединениях только положительные степени окисления, и в про
- Металлы в периодической системе Д.И. Менделеева
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами: высокими электропроводностью и теплопроводностью
- Получение уксусной кислоты
1. Литературный обзор1.1 Свойства и применение ацетальдегидаАцетальдегид (этаналь, уксусный альдегид) СНзСНО представляет собой бесцве
- Производство синтетического пантотената кальция (витамина В3)
Пантотеновая кислота (витамин В3) открыта Р. Вильямсом в 1933 г. Она была им охарактеризована как стимулятор роста дрожжей. Название свое в
- Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда была одной из самых важных проблем, стоящих перед человеческим обществом.Все, кроме кислорода, человек получает д
 www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.