Методы изучения наследственности человека
1. Общие черты методов изучения наследственности человека, наследственные заболевания, их профилактика
2. Генеалогический метод
3. Близнецовый метод
4. Цитогенический метод
Заключение
Список литературы
Согласно законам наследования все основные признаки и свойства организмов контролируются и определяются единицами наследственной информации - генами, локализованными в специфических структурах клетки - хромосомах. Веществом, в котором "записана" наследственная информация, у подавляющего большинства организмов являются нуклеиновые кислоты - дезоксирибонуклеиновая кислота (ДНК), а у некоторых вирусов рибонуклеиновая кислота (РНК). Предметом исследования генетики служит природа материальных носителей наследственности, механизмы их проявления, изменения и воспроизведения, возможные пути и методы их искусственного синтеза, формирование сложных свойств и признаков целостного организма, взаимосвязь наследственности и изменчивости, отбора и эволюции. Изучение наследственности и изменчивости методами генетики осуществляется на всех уровнях организации живой материи: молекулярном, клеточном, на уровне целостного организма и популяции (совокупности особей одного вида, длительно занимающей определенное пространство и воспроизводящей себя во многих поколениях).
Современная генетика, руководствуясь принципами общности в организации всего живого, диалектически взаимодействует с физикой, химией, математикой и другими естественными науками, является основой современной биологии.
Цель работы – рассмотреть методы наследственности человека.
Задачи работы – описать общие черты методов изучения наследственности человека, наследственные заболевания, изучить методы профилактики; рассмотреть такие методы наследственности как гениологический, близнецовый, цитогенический.
1. Общие черты методов изучения наследственности человека, наследственные заболевания, их профилактика
Материальные основы наследственности человека: 46 хромосом, из них 44 аутосомы и 2 половые хромосомы, много тысяч расположенных в них генов.
Цель изучения наследственности человека — выявление генетических основ заболеваний, поведения, способностей, таланта.
Методы изучения генетики человека, зависимость их использования от биологических, психологических и социальных особенностей (позднее появление потомства, его малочисленность, неприменимость метода гибридологического анализа).
Генеалогический метод изучения наследственности человека — изучение родословной семьи с целью выявления особенностей наследования признака в ряду поколений. Выявлено: доминантный и рецессивный характер ряда признаков, генетическая обусловленность развития музыкальных и других способностей, наследственный характер заболеваний диабетом, шизофренией, предрасположенности к туберкулезу.
Цитогенетический метод — изучение структуры и числа хромосом в клетках, выявление свыше 100 изменений в структуре хромосом, изменение числа хромосом (болезнь Дауна).
Близнецовый метод — изучение наследования признаков у близнецов, влияния генотипа и среды на развитие их биологических и психологических особенностей.
Профилактика наследственных заболеваний. Зависимость формирования признаков от генотипа и условий среды. Борьба с загрязнением окружающей среды мутагенами, отказ от употребления алкоголя, наркотических веществ, курения.
Клинико-генеалогический метод чаще других используется в генетике психических болезней. Его сущность состоит в прослеживании в родословных проявлений патологических признаков с помощью приемов клинического обследования с указанием типа родственных связей между членами семей.
Этот метод используется для установления типа наследования болезни или отдельного признака, определения местоположения генов на хромосомах, оценки риска проявления психической патологии при медико-генетическом консультировании. В генеалогическом методе можно выделить 2 этапа — этап составления родословных и этап использования генеалогических данных для генетического анализа.
Составление родословной начинают с человека, который был обследован первым, его называют пробандом. Обычно это бывает больной или индивид, у которого есть проявления изучаемого признака (но это не обязательно). Родословная должна содержать краткие сведения о каждом члене семьи с указанием его родства по отношению к пробанду. Родословную представляют графически, используя стандартные обозначения. Поколения указывают римскими цифрами сверху вниз и ставят их слева от родословной. Арабскими цифрами обозначают индивидов одного поколения последовательно слева направо, при этом братья и сестры или сибсы, как их называют в генетике, располагаются в порядке даты их рождения. Все члены родословной одного поколения располагаются строго в один ряд и имеют свой шифр (например, III-2).
По данным о проявлении заболевания или какого-то изучаемого свойства у членов родословной с помощью специальных методов генетико-математического анализа решается задача установления наследственного характера заболевания. Если установлено, что изучаемая патология имеет генетическую природу, то на следующем этапе решается задача установления типа наследования. Следует обратить внимание на то, что тип наследования устанавливается не по одной, а по группе родословных. Подробное описание родословной имеет значение для оценки риска проявления патологии у конкретного члена той или иной семьи, т.е. при проведении медико-генетического консультирования.
При изучении различий между индивидами по любому признаку возникает вопрос о причинных факторах таких различий. Поэтому в генетике психических заболеваний широко используется метод оценки соотносительного вклада генетических и средовых факторов в межиндивидуальные различия по подверженности тому или иному заболеванию. Этот метод основан на предположении, что фенотипическое (наблюдаемое) значение признака у каждого индивида является результатом влияния генотипа индивида и тех условий среды, в которых происходит его развитие. Однако у конкретного человека определить это практически невозможно. Поэтому вводятся соответствующие обобщенные показатели для всех людей, позволяющие затем в среднем определить соотношение генетического и средового влияния на отдельного индивида. Эта задача решается на основе введения такого статистического показателя, как дисперсия признака, который в генетике называют фенотипическая дисперсия (Vp).
А - пример семьи из 3 поколений (объяснение в тексте); Б - основные обозначения, используемые в родословных.
Фенотипическая дисперсия может быть представлена в виде суммы двух дисперсий, одна из которых характеризует разнообразие, обусловленное влиянием генетических факторов (VG), а другая — влияние средовых факторов (VE):
VP = VG + VE.
С приведенными показателями связаны такие понятия, как показатель "генетического разнообразия" (G):
G = VG/VP
и показатель "средового разнообразия" (Е):
Е = VE/VP.
В указанных формулах символы обозначают первые буквы английских слов: V — варианса (variance), P — фенотипическая (phenotypic), G — генетическая (genetic), Е — средовая (environmental).
Во многих случаях значительный интерес представляет не только общая оценка роли генетических и средовых факторов, но и отдельные компоненты дисперсии, обусловленные такими факторами.
В генетической составляющей обычно выделяют компоненту, которая характеризует влияние отдельных аллелей генов (GA) — аддитивную (additive) генетическую компоненту, или коэффициент наследуемости (h2), и влияние пар аллелей, которое характеризует внутрилокусное взаимодействие — доминантную (dominant) генетическую компоненту (GD).
Средовая компонента дисперсии также может быть представлена в виде нескольких составляющих, или компонент. Прежде всего выделяют компоненту дисперсии, которая обусловлена влиянием среды и действует сходным образом на группу индивидов. Это влияние так называемых систематических (common) средовых факторов (Ес), которые в свою очередь могут быть подразделены также на отдельные типы. Другая группа эффектов средовых факторов характеризуется тем, что они действуют на индивида случайным образом; соответствующая компонента средовой дисперсии обозначается Ew.
Рассмотренные показатели генетической и средовой детерминации, составляя важнейшую часть генетического анализа в психиатрии, однако, не отвечают в полной мере на вопрос о влиянии генетических и средовых факторов на проявления признака у конкретного человека. Так, если установлено, что разнообразие признака обусловлено преимущественно генетическими факторами, то это указывает на существование генетических механизмов детерминации заболевания или признака, а обратное утверждение не всегда верно. Например, если группа обследованных представлена индивидами с одним и тем же генотипом, то не будет генотипического разнообразия и соответственно показатель наследуемости будет равен 0. Таким образом, показатель генетической детерминации отражает влияние генетических факторов на межиндивидуальное разнообразие, а не вообще на наличие генетических механизмов детерминации признаков. Коэффициенты наследуемости характеризуют популяцию, и для одного и того же заболевания или признака они могут иметь разные значения в зависимости от конкретных различий в структуре популяций, например в зависимости от различий в частотах генотипов.
В генетике психических болезней основным подходом для оценки влияния генетических и средовых факторов на межиндивидуальные различия является анализ корреляций между родственниками. Способы вычисления коэффициентов зависят от характера распределения фенотипических значений анализируемых признаков (количественные, альтернативные номинально-дихотомические или квазинепрерывные) и типа родственников.
На основе концепции идентичности генов по происхождению установлено соотношение генетических компонент дисперсии в корреляциях между родственниками.
При исследованиях были получены результаты по подверженности к ряду психических заболеваний. Коэффициент корреляции между родственниками первой степени родства по подверженности к шизофрении, по последним данным, равен 0,35, и соответственно наследуемость подверженности к шизофрении достаточно высока — 70 %. Результаты исследований по генетической детерминации подверженности к эпилепсии при использовании разных критериев определения фенотипа "эпилепсия" также указывают на высокую наследуемость этого заболевания (50—78 %). Высокий коэффициент наследуемости получен и в отношении подверженности к аффективным психозам (70 %). При этом вклад генетических факторов в подверженность к маниакально-депрессивному психозу равен 76 %, а к депрессии — 46 %(1).
В общей генетике накоплены факты, свидетельствующие о влиянии пола на наследование того или иного заболевания или признака. Речь идет о неравном участии женских и мужских гамет в формировании зиготы и организма в целом. Эти различия объясняются неравным количеством цитоплазмы в яйцеклетке и сперматозоиде; в последнем ее меньше, что и определяет по ряду признаков большее влияние матери, т.е. большее сходство потомков с матерью (матроклиния), чем с отцом. Считают, что в основе этого влияния лежат следующие причины: 1) передача через цитоплазму различных симбионтов клетки (часто вирусов), способных редуплицироваться и вследствие этого имитирующих цитоплазматическую наследственность; 2) случайность и неравномерность распределения цитоплазматических элементов, связанных с наследственными структурами (митохондрии, центриоли) по дочерним клеткам; 3) особенности самой цитоплазмы, которые могут возникнуть как под влиянием внешней среды (средовая предетерминация), так и под влиянием генотипа матери (генотипическая предетерминация).
С рассмотренными явлениями связано широко распространенное понятие "материнский эффект". Генотипическая предетерминация по существу представляет собой классическое определение материнского эффекта в "узком" смысле слов. Характерной особенностью такого эффекта является то, что он обусловлен действием ядерных генов матери, которые изменяют цитоплазму яйцеклетки до оплодотворения. В результате потомство развивается в соответствии с генотипом матери независимо от собственного генотипа. Вероятно, это объясняется тем, что в яйцеклетке накапливается значительное количество мРНК, которая используется в развитии зиготы. При психических заболеваниях ситуация усложняется тем, что сходство детей с матерью может быть обусловлено также внутриутробной и постнатальной средой. Поэтому все причины матроклинии можно объединить в понятие "материнский эффект" в "широком" смысле слов. Например, имеются данные о влиянии матери на возраст начала болезни Гентингтона. Согласно этим данным, позднее начало болезни встречается при заболевании матери в 2 раза чаще, чем при заболевании отца. Показано также, что дети больных эпилепсией матерей в 1,5—2 раза чаще заболевают эпилепсией, чем дети больных отцов. Сложность оценки наличия материнского эффекта обусловлена также тем, что различие между родственниками может быть обусловлено и возможным эффектом генов, расположенных в Х-хромосоме, т.е. с учетом их пола.
Конкретные механизмы материнского эффекта для каждого случая могут быть различными и требуют специального исследования. Одним из таких механизмов может быть гетерозиготность матери по аллелю, влияние которого сказывается на проявлении признака ребенка в виде фенокопии. Примером такого механизма может служить поражение мозга у плодов гетерозиготных женщин по гену фенилкетонурии (ФКУ). Результаты исследований свидетельствуют о том, что примерно у 25 % сибсов пробандов с ФКУ имеется церебральная патология, которая объясняется внутриутробной гиперфенилаланемией и обусловлена эффектом гетерозиготной матери. В данном случае знание механизма материнского эффекта позволяет осуществить специальные профилактические мероприятия для предупреждения поражения детей гетерозиготных матерей.
Одним из вариантов клинико-генеалогического метода является изучение приемных детей. В основе этого метода лежит то обстоятельство, что дети, выросшие в семьях приемных родителей, имеют гены своих биологических родителей, а влияние среды определяется условиями, в которых живут приемные родители. Поэтому возможно определить вклад не только генетических факторов в подверженность к психическому заболеванию, но и вклад факторов средовых (в том числе условий проживания, воспитания в семьях и др.). Так, исследования, выполненные с учетом современных методических требований на большой выборке приемных детей, матери которых были больны шизофренией, и контрольной группе матерей, свидетельствуют о преобладающем вкладе генетических факторов на развитие заболевания. Коэффициент наследуемости, вычисленный по этим данным, оказался равным 70 %.
Влияние семейной среды на подверженность к проявлению заболевания в соответствии с рассматриваемым методом также может быть определено, если обеспечено сравнение следующих групп: дети больных родителей, воспитанные психически здоровыми приемными родителями; дети психически здоровых родителей, воспитанные психически больными приемными родителями; дети, у которых родные и приемные родители психически здоровы. Так, удвоенная корреляция по подверженности к проявлению заболевания у детей, биологические родители которых больны, а приемные родители здоровы, даст величину вклада генетических факторов в подверженность к заболеванию. Корреляция по подверженности к проявлению заболевания для детей, биологические родители которых здоровы, а приемные родители больны, свидетельствует о влиянии постнатальной общесемейной среды на подверженность к заболеванию. Влияние внутриутробной среды на подверженность к заболеванию может быть получена с помощью пар родители—дети в семьях, где приемные родители здоровы, а биологические родители больны.
Учитывая возможную роль генов, расположенных в Х-хромосоме, оценка влияния внутриутробных факторов равна разности между корреляциями мать—сын и отец—дочь. Оценка материнского эффекта на подверженность к проявлению психической патологии может быть получена также при изучении полусибсов, т.е. детей, один из родителей которых является общим, а другой — нет. Различают полусибсов, у которых мать одна, а отцы разные, и полусибсов, у которых отец один, а матери разные. Сравнение групп полусибсов с общей матерью или отцом, с наличием или отсутствием у родителей психической патологии позволяет установить влияние внутриутробных факторов на возникновение психической патологии у детей. Учитывая возможный эффект Х-хромосомы, такая оценка может быть получена как разность между корреляциями полусибсов мужчин по материнской и полусибсов мужчин по отцовской линии, когда соответственно мать и отец больны.
Указанные приемы являются достаточно простыми, чтобы оценить перспективность дальнейших специально организованных исследований по изучению роли материнского эффекта на фенотипическое проявление признака.
3. Близнецовый метод
Близнецовый метод в антропогенетике и медицинской генетике - метод оценки соотносительной роли наследственности и среды в становлении фенотипа, основанный на сопоставлении однояйцовых и двуяйцовых близнецов или однояйцовых близнецов, воспитанных раздельно.
Метод исследования, предложенный Ф. Гальтоном в 1875 г, характеризующийся сравнением психологических и иных качеств монозиготных близнецов, имеющих идентичный генный набор, и дизиготных, генотипы которых различны. Данный метод, основанный на предпосылке, что средовое влияния, оказываемое на близнецов, имеет примерное равенство, предназначен для выявления влияния генотипа и среды на изучаемое психологическое качество.
Близнецовый метод — стратегия исследования, предложенная Ф. Гальтоном в 1875 г. Характеризуется сравнением психологических качеств монозиготных близнецов, имеющих идентичный генный набор, и дизиготных, генотипы которых различны. Данный метод, основанный на предпосылке, что средовое влияния, оказываемое на близнецов, имеет примерное равенство, предназначен для выявления влияния генотипа и среды на изучаемое психологическое качество. При контролировании данного свойства генотипом сходство монозиготных близнецов должно быть большим, чем сходство дизиготных близнецов.
Психогенетика - сравнительно новая самостоятельная научная дисциплина. Основной задачей психогенетических исследований является изучение причины происхождения индивидуальных различий и выяснение роли наследствен ых исредовых факторов, лежащих в основе разительного несходства людей по самым разнообразным характеристикам (скорость реакции, память, успешность обучения, уровень интеллекта и т.д.). Как и во всех остальных направлениях психологии в психогенетике используются разнообразные экспериментальные методы изучения реакций и поведения, но в случае психогенетических исследований особенно остро стоит вопрос надежности полученных результатов. То есть существует потребность надежного разделения результатов воздействия генотипа и окружающей среды на реакции исследуемого объекта. Основы метода близнецовых исследований. Как известно, у большинства млекопитающих в одном помете рождается более одного детеныша. Это связано с тем, что во время овуляции происходит созревание нескольких яйцеклеток одновременно(2).
Каждый организм характеризуется определенным набором хромосом, который называется кариотипом. Кариотип человека состоит из 46 хромосом – 22 пары аутосом и две половые хромосомы. У женщины это две X хромосомы (кариотип: 46, ХХ), а у мужчин одна Х хромосома, а другая – Y (кариотип: 46, ХY). В каждой хромосоме находятся гены, ответственные за наследственность. Исследование кариотипа проводится с помощью цитогенетических и молекулярно-цитогенетических методов.
Кариотипирование – цитогенетический метод - позволяющий выявить отклонения в структуре и числе хромосом, которые могут стать причиной бесплодия, другой наследственной болезни и рождения больного ребенка.
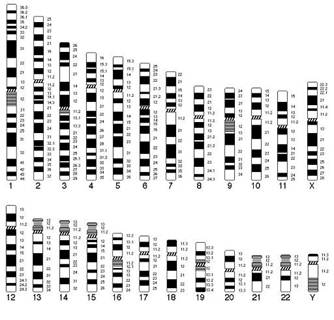
Рис.1. Схематическое изображение хромосом человека при G-окрашивании в соответствии с международной классификацией
В медицинской генетике имеют значение два основных типа кариотипирования:
изучение кариотипа пациентов
пренатальное кариотипирование - исследование хромосом плода.
В 1956г. было доказано, что в соматических клетках человека содержится 46 хромосом (в половых 23 хромосомы) - носителей генетической информации. В конце 60-х – начале 70-х годов были разработаны методы, позволяющие различить каждую хромосому и исследовать ее структуру. Благодаря этому было установлено, что множество тяжелых врожденных заболеваний определяется нарушениями структуры хромосом или их количества в клетке.
Ряд нарушений структуры или количества хромосом не проявляется никакими симптомами. Единственной причиной для обращения к врачу у таких пациентов может быть бесплодие. Поэтому клиника репродукции является нередко единственным учреждением, где такое нарушение может быть выявлено и приняты меры для его преодоления.
Кариотипирование при бесплодии показано в следующих случаях:
Необструктивная азооспермия
Тяжелая олигозооспермия (<5 млн/мл).
Задержка полового развития
Первичная аменорея
Вторичная аменорея (преждевременная менопауза)
Привичное невынашивание раннего срока беременности (наличие 2 и более самопроизвольных абортов в первом триместре беременности) - обследуются оба родителя. В семьях с отягощенным акушерским анамнезом (привычное невынашивание, особенно ранних сроков, мертворождение, рождение ребенка с множественными врожденными пороками развития (МВПР) - хромосомные нарушения встречаются от 5 до 15% случаев
Обследование доноров спермы и яйцеклеток.
В некоторых случаях цитогенетического исследования бывает недостаточно для выдачи заключения о кариотипе, в этих случаях используют молекулярно-цитогенетические методы в частности флуоресцентную гибридизацию in situ (FISH). Метод – FISH позволяет выявлять более тонкое строение отдельных районов определенных хромосом, быстро исследовать какой либо хромосомный участок в различных тканях (органах). Он актуален в тех случаях, когда исследуемый материал имеется в малом количестве.
Метод позволяет идентифицировать кариотип (особенность строения и число хромосом), путем записи кариограммы. Цитогенетическое исследование проводится у пробанда, его родителей, родственников или плода при подозрении на хромосомный синдром либо другое хромосомное нарушение.
Объектом исследования служат культуры лимфоцитов периферической крови, фибробластов кожи, клеток других тканей.
С помощью метода определяется наличие Х и У полового хроматина, определяющего истинную половую принадлежность. Половой хроматин (тельце Барра) - в виде компактной глыбки в ядрах соматических клеток имеется только у женщин. Он определяется в эпителиальных клетках ротовой полости, вагинальном эпителии и клетках волосяной луковицы.
Показания для цитогенетического обследования больного:
1) множественные пороки развития (с вовлечением трех и более систем); наиболее постоянные нарушения - пороки развития головного мозга, опорно-двигательной системы, сердца и мочеполовой системы;
2) умственная отсталость в сочетании с нарушениями физического развития, дисплазиями, гипогенитализмом;
3) стойкое первичное бесплодие у мужчин и у женщин при исключении гинекологической и урологической патологии;
4) привычное невынашивание беременности, особенно на ранних стадиях;
5) нарушение полового развития (гипогонадизм, половые инверсии);
6) небольшая масса ребенка, рожденного при доношенной беременности.
Применение цитогенетического метода в клинической генетике обусловило развитие нового направления - клинической цитогенетики, которая позволяет:
- установить происхождение структурно перестроенных хромосом и их точную классификацию;
- выделить синдромы, обусловленные дисбалансом по участкам индивидуальных хромосом;
- накапливать сведения об изменениях хромосом в опухолевых клетках, у больных с наследственными заболеваниями крови и т.д.
Главный недостаток методов, основанных на использовании низших организмов, заключается в невозможности экстраполировать полученные результаты на человека в связи с отсутствием процессов метаболической активации и детоксикации, характерных для всех млекопитающих, включая человека. На практике этот недостаток частично восполняется применением экзогенной системы метаболической активации in vitro. Однако метаболическая активация in vitro может характеризовать только начальные этапы метаболизма и соответственно не дает полного представления о судьбе вещества в целом организме. Поэтому методы, выполняемые на млекопитающих in vitro, имеют несомненно положительные стороны и позволяют регистрировать конечные результаты действия вещества. Для изучения мутагенных эффектов генотоксичных агентов in vivo разработаны различные методы (один из них – метод щелочной элюции ДНК). Наиболее распространенными являются цитогенетические методы. Они включены в качестве одного из основных в общепринятые наборы тест-систем оценки мутагенности химических соединений.
Существует высокая корреляция (более 90%) между способностью химического агента вызывать разрывы хромосом и генные мутации. Несмотря на то, что механизмы этих двух явлений в большинстве случаев различны, цитогенетическая активность вещества может указывать и на его способность индуцировать генные мутации.
В цитогенетических тестах анализируется весь геном целиком непосредственно в микроскоп, что имеет большое значение в случае соединений, которые имеют специфические участки действия (горячие точки). Еще одним преимуществом является то, что эти методы выполняются сравнительно быстро и со сравнительно скромными затратами. Ниже описываются часто используемые цитогенетические методы, выполняемые как in vitro, так и in vivo.
Учет хромосомных аберраций. Изменение числа и структуры хромосом в соматических клетках и зародышевых клетках могут возникать спонтанно или после воздействия физическими и химическими агентами. Нарушения хромосом, возникающие в зародышевых клетках, приводят к разнообразной врожденной патологии у человека. Эти нарушения принято относить к мутациям, которые могут быть разделены на геномные в случае изменения числа хромосом и хромосомные – при структурных нарушениях.
Многочисленные работы последних лет свидетельствуют о том, что накопление хромосомных мутаций в соматических клетках является одним из факторов, индуцирующих развитие клонов злокачественных клеток, а также процессы старения.
Анализ хромосом соматических клеток методически хорошо разработан. Аномалии хромосом в экспериментальных условиях можно индуцировать различными агентами в клеточных культурах и в соматических клетках лабораторных животных in vivo. В последнем случае обычно в качестве модели используют клетки костного мозга животных.
Все хромосомные аберрации, возникающие в соматических клетках человека и животных, учитываемых на стадии метафазы, разделяют на 2 основные группы: хромосомные и хроматидные. Отнесение той или иной аберрации к хромосомному или хроматидному типу зависит от того, на каком уровне (хромосомы или хроматиды) повреждена хромосома, включенная в перестройку.
Аберрации хромосомного типа отражают повреждение хромосомы на предсинтетической стадии (G1-фаза), когда она представляет собой однонитевую структуру, тогда как аберрации хроматидного типа возникают при повреждении хромосомы на двунитчатой стадии, то есть в фазе S и G2. Нередко при повреждении обеих хроматид хромосомы в идентичных локусах возникают изохроматидные разрывы, морфологически неотличимые от аберраций хроматидного типа. Аберрации могут быть простыми и обменными. Нарушение целостности одной или нескольких хромосом с образованием свободных или связанных с ней фрагментов относят к простому типу аберраций, тогда как перестройка участков одной и той же хромосомы или перекомбинации участками между несколькими хромосомами – к обменному типу.
Обменные аберрации могут быть внутрихромосомными и межхромосомными. В зависимости от локализации внутрихромосомные аберрации разделяют на внутриплечевые и межплечевые. При межхромосомных обменах, если ацентрические фрагменты соединяются с центрическими, то обмены классифицируют как симметричные, а в случае соединения центрических фрагментов – как асимметричные. В последнем случае обмен характеризуется появлением полицентрических хромосом и хроматид. Внутрихромосомные и межхромосомные обмены могут быть полными и неполными. При полных обменах происходит воссоединение всех перекомбинирующихся участков поврежденных хромосом(3).
Культура лейкоцитов человека широко используется для изучения радиационного и химического мутагенеза у человека. Изменения лейкоцитов периферической крови человека в процессе культивирования в присутствии ФГА достаточно исследованы.
При таком культивировании происходит гибель всех форм лейкоцитов за исключением малых лимфоцитов, которые претерпевают изменения, приводящие к митозу. Поэтому при анализе митотических клеток, по существу, имеем дело с культурой лимфоцитов.
К достоинствам культуры лимфоцитов человека относятся доступность материала, синхронность клеточной популяции, низкий уровень спонтанного мутирования, отработанность техники культивирования и изученность морфологии хромосом.
Для целей тестирования используют микро- или полумикрометод культуры лимфоцитов. Анализ хромосом проводят на метафазных пластинках с хорошо окрашенными и разбросанными хромосомами. При этом метафазные пластинки не должны иметь большое количество наложений хромосом и уровень конденсации их должен быть таким, чтобы акроцентрические хромосомы были видны в виде четко выраженных структур. Но анализируются метафазные пластинки с хромосомами, вошедшими в анафазу, так как трудно дифференцировать их от парных фрагментов. Из-за технических манипуляций возможны потери хромосом в пластинке. Поэтому при учете хромосомных аберраций обычно анализируется клетка с числом хромосом от 44 до 47.
При тестировании химических соединений на мутагенную активность хромосомные аберрации учитывают без кариотипирования. Кариотипирование метафазной пластинки применяют в специальных исследованиях, например, при изучении распределения повреждений по группам хромосом, их длине.
Долгое время спорным являлся учет пробелов (брешей) в качестве аберраций. В настоящее время принято пробелы регистрировать отдельно, не включая их в число учитываемых аберраций. Частота пробелов в значительной степени зависит от качества окраски и степени спирализации хромосом.
О мутагенной активности судят по частоте хромосомных аберраций, превышающей спонтанный уровень в норме. Типы индуцированных химическими мутагенами аберраций, как правило, аналогичны типам спонтанных аберраций.
При тестировании химических соединений эксперименты проводят в два этапа. Первый этап предполагает обнаружение возможного эффекта вещества в максимальной концентрации, обработку культур проводят на 48 часу роста и фиксируют клетки на 72 часу. При наличии эффекта переходят к изучению зависимости доза-эффект (2-й этап).
Костный мозг млекопитающих является наиболее широко используемой моделью для исследования мутагенной активности химических соединений in vivo. Это связано, во-первых, с тем, что клетки костного мозга имеют высокую пролиферативную активность и, во-вторых, простотой приготовления препаратов. Морфология хромосом большинства видов лабораторных животных хорошо изучена.
Тестирование обычно проводят на мышах, анализируют и учитывают как число метафаз с аберрациями, так и общее число структурных нарушений хромосом.
Клетки костного мозга асинхронны и для установления наиболее чувствительной стадии клеточного цикла анализируют различные клеточные популяции, зафиксированные в различные сроки после воздействия. Рекомендуют фиксировать клетки через 6, 24 и 48 часов после введения животным тестируемого агента.
Уровень хромосомных аберраций в клетках костного мозга достаточно низок и составляет у большинства линий лабораторных мышей 1-2%.
Для работы обычно выбирают линии с низкой и стабильной частотой (=1%) спонтанных аберраций. Мыши CBA/L acY, F1(C3Hx101) и F1(CBAxC57 BL/6) имеют низкий уровень спонтанных аберраций. Однако они по чувствительности к действию ряда мутагенов существенно отличаются друг от друга.
Метод учета хромосомных аберраций в клетках костного мозга млекопитающих является составной частью практически всех комплексов методов оценки мутагенных свойств у химических веществ, принятых почти во всех странах мира проводящих такую оценку.
Сестринские хроматидные обмены. Феномен обмена участками между сестринскими хроматидами одной хромосомы привлек внимание исследователей мутагенных факторов окружающей среды своей высокой чувствительностью. Так, изучение уровней индукции СХО и хромосомных аберраций при действии 5 мутагенными агентами на лимфоциты человека in vitro и на клетки костного мозга мышей in vivo показало, что эффективность индукции СХО in vitro в 300-30 раз превышает эффективность образования аберраций хромосом. Та же закономерность сохранялась при действии in vivo, но соотношение снижалось до 60-20 раз (Щеглова Е.Г., Чеботарева А.Н., 1985).
Принцип метода обнаружения СХО заключается в воздействии на клетки таким образом, чтобы две сестринские хроматиды отличались друг от друга. Достигается это введением в растущую культуру клеток 5-бромдезоксиуридина (БДУ) с последующей окраской препаратов. БДУ присутствуют в среде в течение двух клеточных циклов. Хроматиды, включившие БДУ в обе субъединицы, выглядят на окрашенных препаратах более светлыми, чем хроматиды, включившие его в одну субъединицу или не включившие вообще. Данный подход был предложен А.Ф.Захаровым и Н.А.Еголиной (1972) и является основой всех современных методов обнаружения СХО, так как все последующие разработки сводятся лишь к использованию различных красителей для различения двух сестринских хроматид, в разной степени включивших БДУ(4).
Природа СХО до сих пор остается не выясненной и этой проблеме посвящено много работ. Основной вопрос заключается в том, что следует ли считать СХО прямым генетическим эффектом или следствием определенных типов повреждений ДНК. В этой связи понятен интерес исследователей к выяснению взаимосвязи между СХО, мутагенезом и повреждениями ДНК.
Клетки китайского хомячка V 79 обрабатывали различными химическими веществами и исследовали взаимосвязь между повреждениями ДНК, токсичностью, мутагенностью и индукцией СХО. Транс-Pt (II) диаминодихлорид, не являющийся мутагеном, приводил к образованию почти такого же количества СХО, как и высокомутагенный цис-Pt (II) диаминдихлорид. Поскольку эти препараты не приводят к образованию однонитевых разрывов в ДНК, то можно было предположить, что СХО является следствием каких-то других повреждений, например, сшивок ДНК-ДНК или ДНК-белок. Транс-Pt (II) образует почти в 20 раз больше сшивок ДНК-белок, чем цис-Pt (II), однако количество сшивок ДНК-ДНК в этих случаях одинаково. Таким образом, было показано, что существует более тесная связь между С
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Методы микробиологической диагностики
Микробиологическая диагностика в первую очередь необходима для определения причины инфекционных заболеваний. Существует 5 основных м
- Механизм взаимодействия вируса и клетки
1. Типы взаимодействия вируса с клеткой2. Адсорбция вируса3. Проникновение вируса в клетку4. Синтез вирусных белков5.
- Механизмы выживания бактерий в окружающей среде
Выяснение причин того, каким образом бактерии адаптируются к различным условиям окружающей среды, имеет очень важное значение для нау
- Механика микрочастиц
Современная наука – феномен весьма сложный и неоднозначный. Ее уже невозможно охарактеризовать одним словом, как это было с предшеств
- Микробная коррозия и ее возбудители
ВведениеВ связи с бурным развитием промышленности резко возросли размеры коррозионных повреждений металлических и неметаллических к
- Микроклональное размножение Ириса Низкого путем изолирования зародыша как способ сохранения вида
Проблема охраны видов растений в настоящее время становиться актуальной вследствие нерационального использования природных ресурсо
- Микроорганизмы, выделенные из различных природных жиров
Применение микробиологических технологий в мире получает все большее распространение. Как свидетельствуют аналитические прогнозы, о
 www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

