Слабые взаимодействия – сильные воздействия
А.А. Замятнин, Институт биохимии им. А.Н. Баха РАН, г. Москва
Увидев в заголовке статьи термин «слабые взаимодействия», возможно, кто-то подумает, что речь пойдет об элементарных частицах. Не знаю, разочарую я их или нет, но далее никакого упоминания об элементарных частицах не будет.
Дело в том, что термин «слабые взаимодействия» (как, впрочем, и сильные) в результате несоблюдения семантической гигиены (термин Н.В. Тимофеева-Ресовского) используется не только в физике элементарных частиц. В частности, эти взаимодействия характерны для огромного числа органических веществ, среди которых особое положение занимают вещества биологической природы – белки, нуклеиновые кислоты, углеводы, липиды и многие другие. Их структура определяется двумя факторами.
Атомы в молекулах этих веществ соединены ковалентными связями (сильные взаимодействия), формирующими химическую структуру. Однако реальная конфигурация зависит от наличия у них разнообразных химических групп, которые внутри молекулы на основании законов физики могут специфически взаимодействовать друг с другом (слабые взаимодействия) и формировать уникальную пространственную структуру. Более того, возникающая при этом система слабых внутримолекулярных взаимодействий в силу ряда причин может изменяться, перестраиваться, в результате чего молекула приобретает разнообразные формы и наделяется способностью участвовать еще и во множестве слабых межмолекулярных взаимодействий.
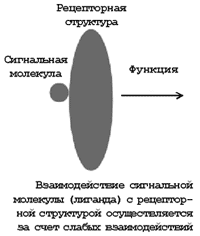
Межмолекулярные взаимодействия являются первичным актом многоэтапного процесса, который заканчивается макроскопическими изменениями живого организма. Сложность и многообразие системы слабых взаимодействий в живой природе требует от исследователя использования разнообразных методов и подходов, большинство из которых на сегодняшний день основаны на высоких технологиях.
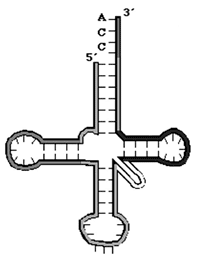
«Клеверный лист» молекулы транспортной РНК образуется за счет внутримолекулярных слабых взаимодействий (водородных связей) между азотистыми основаниями |
Наиболее ярко продемонстрировать слабые взаимодействия можно на примере белков, для которых из-за отсутствия теоретической базы до сих пор не решена фундаментальная задача формирования пространственной структуры и не ясны механизмы их взаимодействия с многими другими молекулами.
На сегодняшний день известно около 2 млн белков с разной химической структурой, синтезируемых особыми структурными элементами живой клетки – рибосомами. Молекулы всех белков обладают общим свойством: их характеризует линейная последовательность повторяющихся трех химических групп, соединенных ковалентными связями, которые представляют собой остов белковой молекулы. Вокруг этих связей может происходить вращение. К одной из трех групп (всегда одной и той же) присоединен специфический боковой радикал (один из 20 возможных). Участок остова, состоящий из трех химических групп с присоединенным боковым радикалом, представляет собой аминокислотный остаток. В процессе синтеза белка на рибосоме аминокислотные остатки образуются из аминокислот и занимают свое положение в белке, соединяясь друг с другом специфической ковалентной связью, называемой пептидной. Поэтому все соединения такого типа называются пептидами. Число аминокислотных остатков в одной молекуле может превышать 30 тыс.
|
Слабые взаимодействия, например водородные связи, между химическим группами остова во многих белках приводят к образованию в них регулярных участков, представляющих собой спирали или слоистые структуры. Однако уникальная пространственная структура образуется с участием и ряда других слабых взаимодействий между боковыми радикалами. Большое их число (несмотря на слабость) обусловливает то, что белковая молекула может обладать стабильной пространственной конфигурацией.
Среди 20 видов боковых радикалов имеются заряженные (положительно или отрицательно), гидрофобные, гидрофильные, содержащие циклические группы и др. Их сближение характеризуется целым спектром слабых взаимодействий: ионных, ион-дипольных, диполь-дипольных (разнообразных вандерваальсовских – совокупность ориентационных, индукционных и дисперсионных сил), гидрофобных и др. Энергия U слабых взаимодействий в разной степени n зависит от расстояния r между взаимодействующими элементами:
U ~ 1/rn.
Для сравнения в таблице представлены характеристики различных типов слабых взаимодействий и ковалентных связей (сильные взаимодействия) в белках.
| Тип взаимодействий | n | Энергия, кДж/моль |
| Ковалентные связи | – | >300 |
| Ионные взаимодействия | 1 | <100 |
| Ион-дипольные взаимодействия | 2 | 15–40 |
Диполь-дипольные взаимодействия (вандерваальсовские) | 4, 6 | 4–100 |
| Водородные связи | 2 | 10–30 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Фумаровая кислота: применение в птицеводстве и свиноводстве
Черный Н.В., Дегтярев Н.А., Жейнова Н.Н.Харьковская государственная зооветеринарная академия, Украина Фумаровая кислота - транс этилен - 1
- Стеллерова корова
Краткий рассказ об одном из ярчайших представителей черной книги - морской корове Стеллера, истребленной всего за несколько лет с моме
- Бродиеа
Род Бродиеа (Brodiaea) состоит из 40 многолетних клубнелуковичных малоустойчивых видов растений. Некоторые из них отличаются особой декора
- Биологические часы
С.Э. Шноль, Московский государственный университет им. М.В. Ломоносова, лаборатория физической биохимии Института теоретической и эксп
- Активизация познавательной деятельности учащихся на уроках химии
Вопросы активизации познавательной деятельности учащихся относятся к числу наиболее актуальных проблем современной педагогической
- Роль микроэлементов в составе удобрений
Черноногов В.Г., агроном ОАО «Буйский химический завод»Элементы питания с приставкой «микро» оказывают макроэффект, если они обеспечи
- Тыласин - тасманийский тигр
Статья посвящена знаменитому тасманийскому тигру, по официальным данным исчезнувшему с лица земли. Энтузиасты всё ещё надеятся отыска
Copyright © https://referat-web.com/. All Rights Reserved
 www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
www.referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.